Tóm tắt Luận án Tổng hợp và đánh giá tác dụng sinh học các dẫn xuất của indirubin

Trang 1

Trang 2

Trang 3

Trang 4

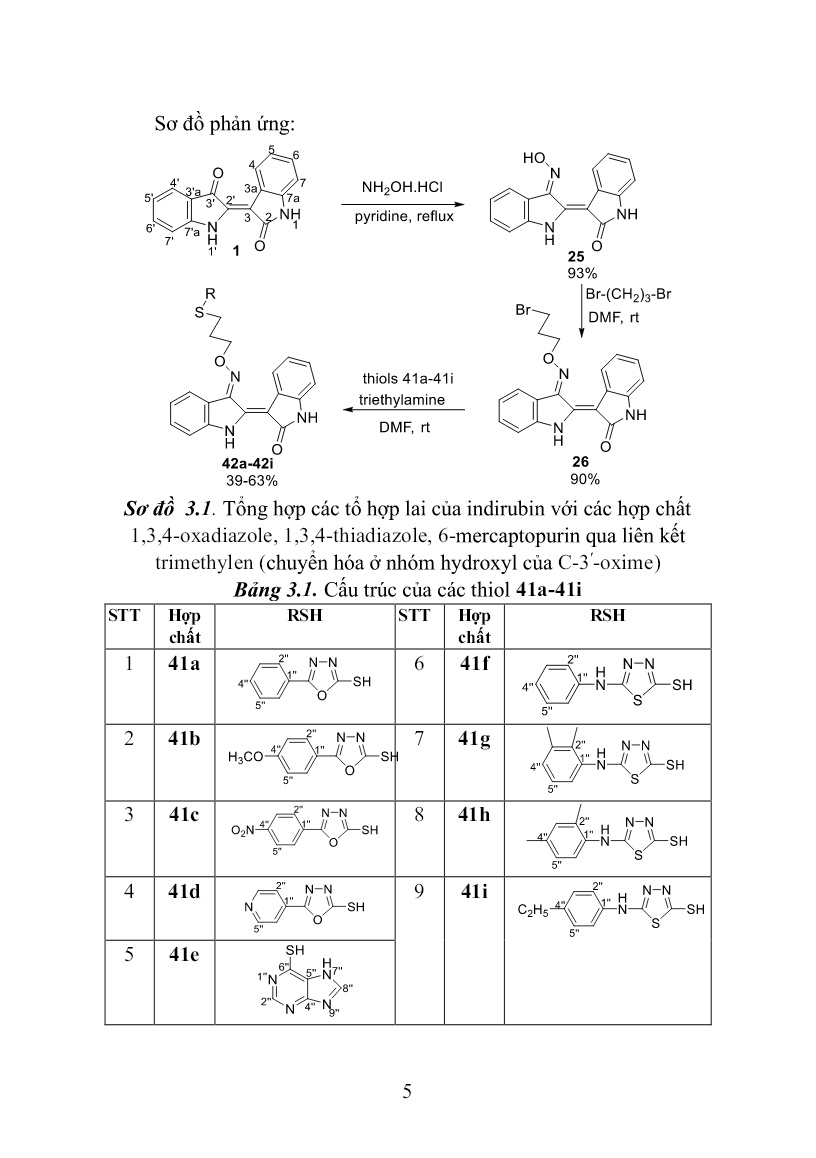
Trang 5

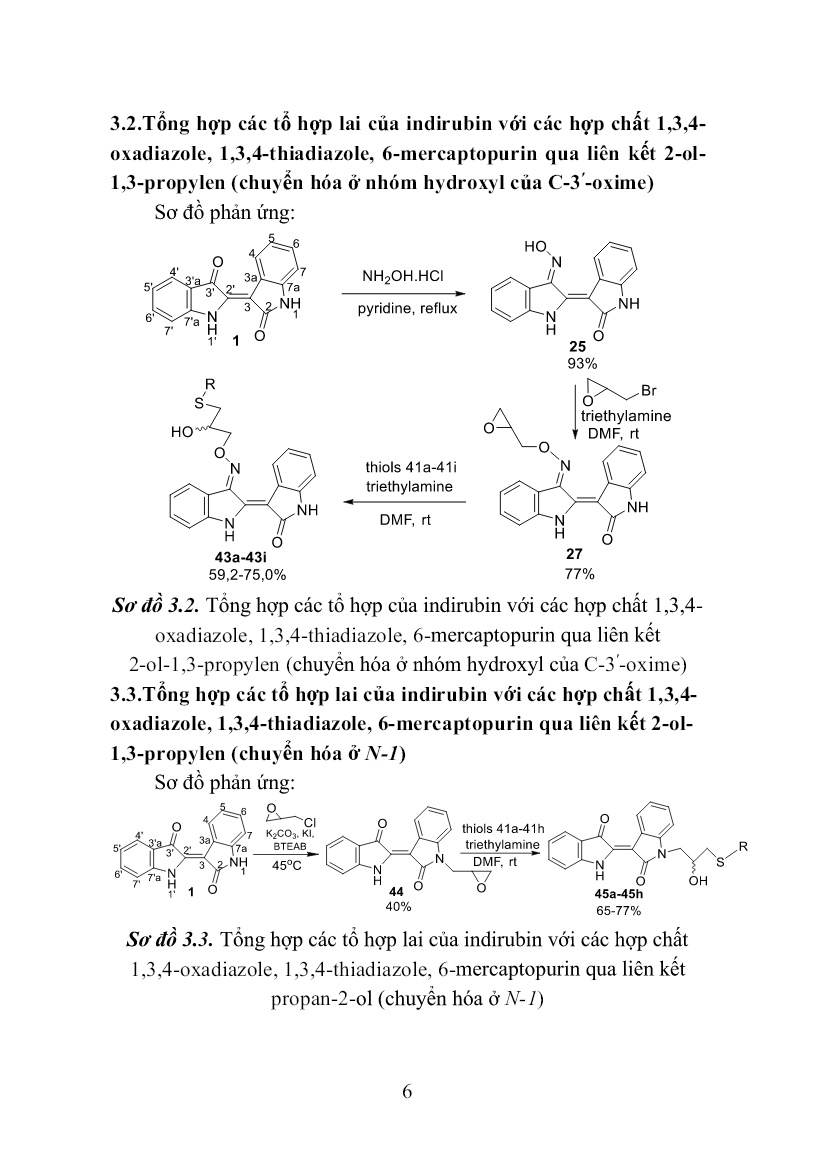
Trang 6
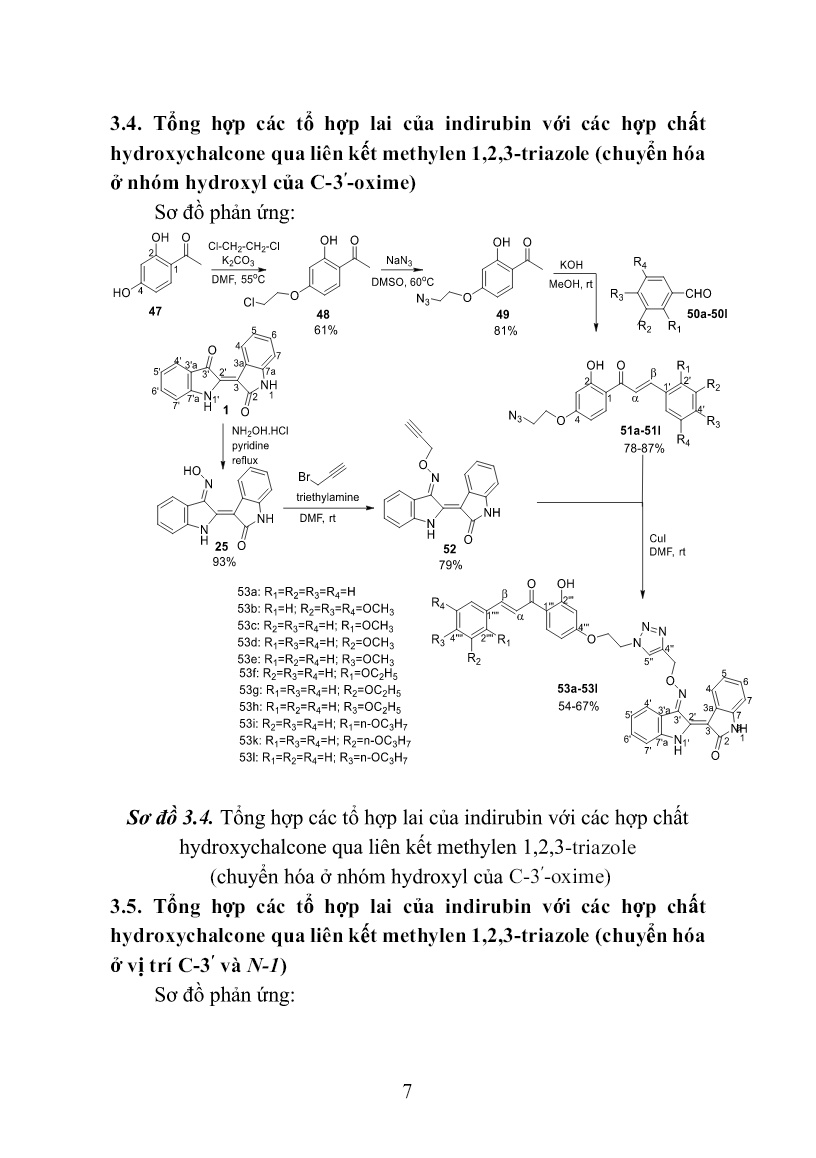
Trang 7
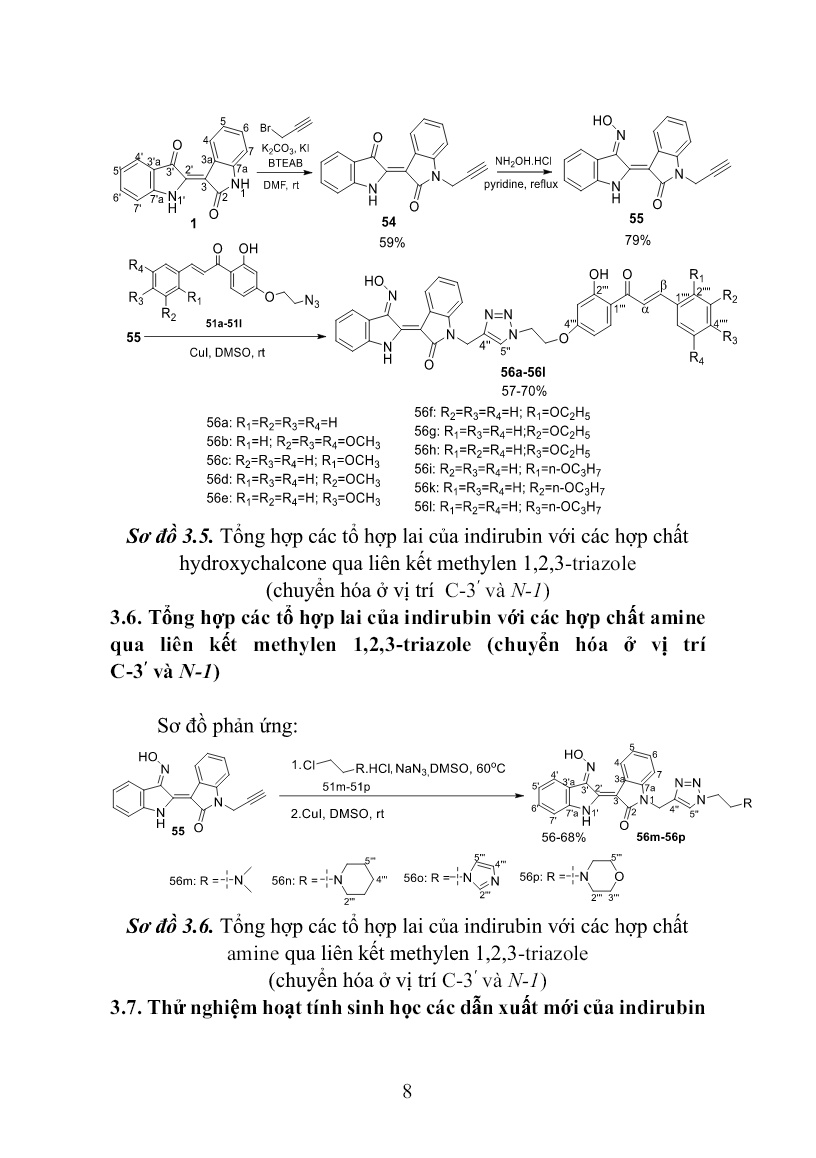
Trang 8
Trang 9
Trang 10
Tải về để xem bản đầy đủ
Bạn đang xem 10 trang mẫu của tài liệu "Tóm tắt Luận án Tổng hợp và đánh giá tác dụng sinh học các dẫn xuất của indirubin", để tải tài liệu gốc về máy hãy click vào nút Download ở trên.
Tóm tắt nội dung tài liệu: Tóm tắt Luận án Tổng hợp và đánh giá tác dụng sinh học các dẫn xuất của indirubin

le, 1,3,4-thiadiazole, 6-mercaptopurin qua liên kết 2-ol- 1,3-propylen (chuyển hóa ở N-1) Sơ đồ phản ứng: Sơ đồ 3.3. Tổng hợp các tổ hợp lai của indirubin với các hợp chất 1,3,4-oxadiazole, 1,3,4-thiadiazole, 6-mercaptopurin qua liên kết propan-2-ol (chuyển hóa ở N-1) 7 3.4. Tổng hợp các tổ hợp lai của indirubin với các hợp chất hydroxychalcone qua liên kết methylen 1,2,3-triazole (chuyển hóa ở nhóm hydroxyl của C-3ʹ-oxime) Sơ đồ phản ứng: Sơ đồ 3.4. Tổng hợp các tổ hợp lai của indirubin với các hợp chất hydroxychalcone qua liên kết methylen 1,2,3-triazole (chuyển hóa ở nhóm hydroxyl của C-3ʹ-oxime) 3.5. Tổng hợp các tổ hợp lai của indirubin với các hợp chất hydroxychalcone qua liên kết methylen 1,2,3-triazole (chuyển hóa ở vị trí C-3ʹ và N-1) Sơ đồ phản ứng: 8 Sơ đồ 3.5. Tổng hợp các tổ hợp lai của indirubin với các hợp chất hydroxychalcone qua liên kết methylen 1,2,3-triazole (chuyển hóa ở vị trí C-3ʹ và N-1) 3.6. Tổng hợp các tổ hợp lai của indirubin với các hợp chất amine qua liên kết methylen 1,2,3-triazole (chuyển hóa ở vị trí C-3ʹ và N-1) Sơ đồ phản ứng: Sơ đồ 3.6. Tổng hợp các tổ hợp lai của indirubin với các hợp chất amine qua liên kết methylen 1,2,3-triazole (chuyển hóa ở vị trí C-3ʹ và N-1) 3.7. Thử nghiệm hoạt tính sinh học các dẫn xuất mới của indirubin 9 Thử nghiệm hoạt tính gây độc tế bào được tiến hành theo phương pháp của Monks (1991) Thử nghiệm hoạt tính chống tăng sinh được tiến hành theo Tim Mosmann (1983) CHƯƠNG IV. KẾT QUẢ VÀ THẢO LUẬN Phần này mô tả kết quả tổng hợp các dẫn xuất mới của indirubin, kết quả thử nghiệm hoạt tính sinh học, kết quả mô phỏng tương tác của các chất sử dụng phần mềm AutoDock 4.2.6 và thảo luận các kết quả đạt được. 4.1. Tổng hợp các dẫn xuất mới của indirubin 4.1.1.Tổng hợp các tổ hợp lai của indirubin với các hợp chất 1,3,4- oxadiazole, 1,3,4-thiadiazole, 6-mercaptopurin qua liên kết trimethylen (chuyển hóa ở nhóm hydroxyl của C-3ʹ-oxime) Các dẫn xuất mới của indirubin 42a-42i được tổng hợp từ indirubin qua 3 bước (sơ đồ 3.1). Trước hết hợp chất 25 được tạo thành bằng phản ứng ngưng tụ của indirubin với hydroxylamine hydrochloride trong dung môi pyridine, hồi lưu 3 giờ. Tiếp theo, 25 được O-alkyl hóa với 1,3-dibromopropane trong dung môi DMF, xúc tác triethylamine nhận được hợp chất trung gian chìa khóa 26. Bước cuối cùng, cho các thiol 41a-41i (bảng 3.1) phản ứng thế nucleophin SN2 với chất trung gian chìa khóa 26 trong dung môi DMF ở nhiệt độ phòng, xúc tác triethylamine, thời gian 20 giờ. Kết thúc phản ứng, sản phẩm thô được tinh chế bằng sắc ký cột/silica gel, hệ dung môi rửa giải chloroform/ethyl acetate (2/1) nhận được chín chất đích 42a-42i với hiệu suất 39÷63%. Cấu trúc của các chất được xác định bằng các phương pháp phổ hiện đại như: NMR -1D, 2D và HR-MS(ESI). 4.1.2.Tổng hợp các tổ hợp lai của indirubin với các hợp chất 1,3,4- oxadiazole, 1,3,4-thiadiazole, 6-mercaptopurin qua liên kết 2-ol-1,3- propylen (chuyển hóa ở nhóm hydroxyl của C-3ʹ-oxime) Các dẫn xuất mới của indirubin 43a-43i được tổng hợp từ indirubin qua 3 bước (sơ đồ 3.2). Trước hết hợp chất 25 được tạo thành 10 bằng phản ứng ngưng tụ của indirubin với hydroxylamine hydrochloride trong dung môi pyridine, hồi lưu 3 giờ. Tiếp theo, nó được O-alkyl hóa với epibromohydrin trong dung môi DMF ở nhiệt độ phòng, xúc tác triethylamine nhận được hợp chất trung gian chìa khóa 27. Bước cuối cùng, cho các thiol 41a-41i phản ứng thế mở vòng epoxy với chất trung gian chìa khóa 27 trong dung môi DMF ở nhiệt độ phòng, xúc tác triethylamine, thời gian 40 giờ. Kết thúc phản ứng, sản phẩm thô được tinh chế bằng sắc ký cột/silica gel, hệ dung môi rửa giải dichloromethane/ethyl acetate (2/1) nhận được chín chất đích 43a-43i với hiệu suất 59,2÷75,0%. Cấu trúc của các chất được xác định bằng các phương pháp phổ hiện đại như: NMR -1D, 2D và HR- MS(ESI). 4.1.3.Tổng hợp các tổ hợp lai của indirubin với các hợp chất 1,3,4- oxadiazole, 1,3,4-thiadiazole, 6-mercaptopurin qua liên kết 2-ol-1,3- propylen (chuyển hóa ở N-1) Các dẫn xuất mới của indirubin 45a-45h được tổng hợp từ indirubin qua 2 bước (sơ đồ 3.3). Đầu tiên phản ứng giữa indirubin 1 với epichlorohydrin được tiến hành trong dung môi DMF ở nhiệt độ 45oC, xúc tác K2CO3, KI, xúc tác chuyển pha (1- butyl)triethylammonium bromide, thời gian 4 ngày. Kết thúc phản ứng, sản phẩm thô được tinh chế bằng sắc ký cột/slica gel, hệ dung môi rửa giải dichloromethane/ethyl acetate (10/1) nhận được chất trung gian chìa khóa 44 với hiệu suất 40%. Bước tiếp theo, các thiol 41a-41h được tham gia phản ứng thế mở vòng epoxy hợp chất trung gian chìa khóa 44 trong dung môi DMF ở nhiệt độ phòng, xúc tác triethylamine, thời gian 40 giờ. Kết thúc phản ứng, sản phẩm thô được tinh chế bằng sắc ký cột/silica gel, hệ dung môi rửa giải chloroform/ethyl acetate (2/1) nhận được tám chất đích 45a-45h với hiệu suất 63,1÷77,0%. Cấu trúc của các chất được xác định bằng các phương pháp phổ hiện đại như: NMR -1D, 2D và HR-MS(ESI). 4.1.4. Tổng hợp các tổ hợp lai của indirubin với các hợp chất 11 hydroxychalcone qua liên kết methylen 1,2,3-triazole (chuyển hóa ở nhóm hydroxyl của C-3ʹ-oxime) Các hợp chất 53a-53i được tổng hợp theo sơ đồ 3.4, trong đó phản ứng Click được sử dụng để ghép các 4-(2-azidoethoxy)-2- hydroxychalcone 51a-51l với indirubin-3ʹ-[O-(prop-2-ynyl)oxime] 52 trong sự có mặt của CuI. Trước hết, các 4-(2-azidoethoxy)-2-hydroxychalcone 51a-51l được tổng hợp từ chất đầu 2,4-dihydroxyacetophenone 47 bằng một qui trình 3 bước với hiệu suất tốt như sau: Ketone 47 được O-alkyl hóa chọn lọc nhóm -OH ở vị trí 4 với 1,2-dichloroethane trong dung môi DMF ở nhiệt độ 55oC, xúc tác K2CO3, thời gian 10 giờ. Kết thúc phản ứng, sản phẩm thô được tinh chế bằng sắc ký cột/silica gel, hệ dung môi rửa giải n-hexan/acetone (3/1) nhận được hợp chất trung gian 4-(2-chloroethoxy)-2-hydroxyacetophenone 48 với hiệu suất 61%, ở đây nhóm -OH ở vị trí 2 không tham gia phản ứng O-alkyl hóa do sự tạo thành liên kết hydro nội phân tử giữa nguyên tử H của nhóm này với nguyên tử O của nhóm C=O trong nhóm 1-acetyl. Tiếp theo, dẫn xuất alkylchloride này được cho phản ứng với NaN3 trong dung môi DMSO ở nhiệt độ 60oC, 24 giờ cho chất trung gian 4-(2- azidoethoxy)-2-hydroxyacetophenone 49 với hiệu suất 81%. Cuối cùng, hợp phần ketone này được ngưng tụ Claisen-Schmidt với các aldehyde gồm benzaldehyde 50a, 3,4,5-trimethoxybenzaldehyde 50b, 2-methoxybenzaldehyde 50c, 3-methoxybenzaldehyde 50d, 4- methoxybenzaldehyde 50e, 2-ethoxybenzaldehyde 50f, 3- ethoxybenzaldehyde 50g, 4-ethoxybenzaldehyde 50h, 2- propoxybenzaldehyde 50i, 3-propoxybenzaldehyde 50k và 4- propoxybenzaldehyde 50l trong MeOH xúc tác bởi KOH để tạo thành các 4-(2-azidoethoxy)-2-hydroxychalcone 51a-51l với hiệu suất 78÷87%. Trong đó có 7 chalcone mới gồm 51a, 51f, 51g, 51h, 51i, 51k, 51l và 4 chalcone cũ 51b, 51c, 51d, 51f được mô tả trong tài liệu trước đó. Các 4-(2-azidoethoxy)-2-hydroxychalcone nhận được là 12 những chất rắn, màu vàng đặc trưng của các chalcone. Cấu trúc của các chất trung gian 48, 49 và các (2-azidoethoxy)-2-hydroxychalcone được xác định bằng các phương pháp phổ NMR và HR-MS(ESI). Tiếp theo, chất trung gian chìa khóa indirubin-3ʹ-[O-(prop-2- ynyl)oxime] 52 được điều chế từ indirubin qua hai bước. Trước hết indirubin-3ʹ-oxime 25 được tạo thành bởi phản ứng ngưng tụ của indirubin với hydroxylamine chlohydric trong dung môi pyridine, hồi lưu 3 giờ. Tiếp theo, hợp chất này được O-alkyl hóa với propargyl bromide trong dung môi DMF ở nhiệt độ phòng, xúc tác triethylamine, 48 giờ. Kết thúc phản ứng, sản phẩm thô được tinh chế bằng sắc ký cột/silica gel, hệ dung môi rửa giải n-hexan/acetone (3/1) nhận được hợp chất trung gian chìa khóa indirubin-3ʹ-[O-(prop-2-ynyl)oxime 52 với hiệu suất 79% tính theo indirubin-3ʹ-oxime. Cấu trúc của hợp chất 52 được xác định bằng các phương pháp phổ NMR và HR-MS(ESI). Bước cuối cùng trong tổng hợp các tổ hợp lai của indirubin với các hợp chất hydroxychalcone qua liên kết methylen 1,2,3-triazole là cho từng 4-(2-azidoethoxy)-2-hydroxychalcone ở trên phản ứng với hợp chất indirubin-3ʹ-[O-(prop-2-ynyl)oxime 52 trong dung môi DMF ở nhiệt độ phòng, xúc tác CuI, 24 giờ. Tiến trình phản ứng được kiểm soát bằng TLC, khi kết thúc phản ứng, hỗn hợp được pha loãng với ethyl acetate, sau đó rửa bằng nước, làm khô bằng Na2SO4 khan, sản phẩm thô được tinh chế bằng sắc ký cột/silicagel, hệ dung môi rửa giải n-hexan/acetone (3/2) nhận được mười một dẫn xuất mới của indirubin 53a-53l với hiệu suất 54÷67%. Cấu trúc của các chất được xác định bằng các phương pháp phổ hiện đại như: NMR -1D, 2D và HR- MS(ESI). 4.1.5. Tổng hợp các tổ hợp lai của indirubin với các hợp chất hydroxychalcone qua liên kết methylen 1,2,3-triazole (chuyển hóa ở vị trí C-3ʹ và N-1) Theo sơ đồ 3.5, các tổ hợp lai 56a-56l của indirubin-3ʹ-oxime với các hợp chất hydroxychalcone qua liên kết methylen 1,2,3-triazole 13 nhận được qua ba bước phản ứng. Trước hết, thực hiện phản ứng N- alkyl hóa giữa indirubin 1 với propargyl bromide trong dung môi DMF khan ở nhiệt độ phòng, sử dụng hệ xúc tác K2CO3, KI, 1- (butyl)triethylammonium bromide, 48 giờ. Kết thúc phản ứng, sản phẩm thô được tinh chế bằng sắc ký cột/silica gel, hệ dung môi rửa giải n-hexan/acetone (4/1) nhận được hợp chất 54 với hiệu suất 59%. Cấu trúc của hợp chất này được xác định bằng phổ NMR, HR- MS(ESI). Tương tự như phản ứng N-alkyl hóa indirubin bằng epichlorohydrin, phản ứng N-propargyl hóa indirubin chỉ xảy ra ở vị trí N-1. Tiếp theo, chất trung gian chìa khóa 55 được tạo thành với hiệu suất 79% bởi phản ứng ngưng tụ giữa 54 với hydroxylamine hydrochloride trong dung môi pyridine. Đơn tinh thể hợp chất 55 dễ dàng được tạo thành trong hệ dung môi n-hexan/acetone (2/1) và được dùng để đo phổ nhiễu xạ tia X đơn tinh thể. Cấu trúc của 55 được xác định bằng phổ NMR, HR-MS(ESI) kết hợp với phổ nhiễu xạ tia X đơn tinh thể. Dữ liệu tinh thể học của hợp chất này đã được gửi đến trung tâm dữ liệu tinh thể học của Anh và được cấp mã số CCDC 1917485, khẳng định cấu trúc của hợp chất 55 tổng hợp được là chính xác và có cấu hình tuyệt đối là (2ʹZindirubin, 3 ʹEoxime) (Hình 4.27). Từ cấu trúc đơn tinh thể của hợp chất 55 khẳng định chất đầu indirubin 1 có cấu hình tuyệt đối 2ʹZ và oxime 25 tạo thành có cấu hình 3ʹE. Cuối cùng, thực hiện phản ứng đóng vòng 1,2,3-triazole giữa hợp chất 55 với từng 4-(2-azidoethoxy)-2-hydroxychalcone 51a-51l trong dung môi DMSO ở nhiệt độ phòng, xúc tác CuI, 24 giờ. Sản phẩm thô được tinh chế bằng sắc ký cột/silica gel, hệ dung môi rửa giải n-hexan/acetone (3/2) nhận được mười một chất đích 56a-56l với hiệu suất 57÷70%. Cấu trúc của các chất đích này được xác định bằng các phương pháp phổ hiện đại như: NMR -1D, 2D và HR-MS(ESI). 14 Hình 4.27. Cấu trúc đơn tinh thể của hợp chất 55 4.1.6. Tổng hợp các tổ hợp lai của indirubin với các hợp chất amine qua liên kết methylen 1,2,3-triazole (chuyển hóa ở vị trí C-3ʹ và N-1) Indirubin và các dẫn xuất có độ tan trong nước rất kém dẫn đến sinh khả dụng thấp. Để cải thiện tính tan các dẫn xuất của indirubin, hợp chất này có thể được ghép với các amine qua cầu liên kết methyl 1,2,3-triazole nhờ phản ứng click chemistry (sơ đồ 3.6). Hợp phần amine được lựa chọn bắt đầu từ các dẫn xuất halogen: 2- chloroethyldimethylamine, 1-(2-chloroethyl)piperidine, 1-(2- chloroethyl)imidazole và N-(2-chloroethyl)morpholine. Các dẫn xuất chloro amine này được chuyển thành các azido của các amine tương ứng bằng NaN3/K2CO3 trong DMSO ở 60 oC. Sau khi ly tâm loại bỏ chất rắn, từng dung dịch azido của các amine thu được cho phản ứng click chemistry với (2ʹZ, 3ʹE)-1-(prop-2-ynyl)indirubin-3ʹ-oxime 55 trong sự có mặt của xúc tác CuI ở nhiệt độ phòng để nhận được các sản phẩm click 56m-56p. Sản phẩm thô được tinh chế bằng sắc kí cột/silica gel rửa giải bằng hệ n-hexane/aceton (1/1) thu các sản phẩm đích 56m-56p với hiệu suất từ 56÷68%. Cấu trúc của các sản phẩm đích được xác định bằng các phương pháp phổ hiện đại như: NMR- 1D, 2D và HR-MS(ESI). 4.2. Đánh giá hoạt tính chống ung thư in vitro các dẫn xuất mới của indirubin 4.2.1. Đánh giá hoạt tính chống ung thư các dẫn xuất mới của indirubin 42a-42i 15 Bảng 4.13. Hoạt tính gây độc và chống tăng sinh tế bào in vitro các dẫn xuất mới của indirubin 42a-42i và các chất đối chứng dương TT Hợp chất IC50 (μM) SW480 LU-1 HepG2 HL-60 1 42a >20 >20 >20 >20 2 42b >20 >20 >20 >20 3 42c >20 >20 >20 >20 4 42d >20 >20 >20 >20 5 42e 2,56 2,92 3,69 2,54 6 42f >20 >20 >20 >20 7 42g >20 >20 >20 >20 8 42h >20 >20 >20 >20 9 42i 4,82 5,19 4,70 5,94 10 6-mercaptopurin 19,10 18,75 19,72 16,04 11 Indirubin >20 >20 >20 >20 12 Indirubin-3ʹ-oxime 14,26 13,11 15,87 14,90 13 Ellipticine 2,19 1,91 1,79 2,40 Kết quả thử nghiệm hoạt tính gây độc và chống tăng sinh tế bào ung thư trên bảng cho thấy hai dẫn xuất 42e và 42i có hoạt tính trên cả bốn dòng tế bào thử nghiệm, giá trị IC50 dao động từ 2,54÷5,94 µM. Bảy dẫn xuất còn lại không thể hiện hoạt tính ở nồng độ nghiên cứu. 4.2.2. Đánh giá hoạt tính chống ung thư các dẫn xuất mới của indirubin 43a-43i Bảng 4.14. Hoạt tính gây độc và chống tăng sinh tế bào in vitro các dẫn xuất mới của indirubin 43a-43i và các chất đối chứng dương TT Hợp chất IC50 (μM) SW480 LU-1 HepG2 HL-60 1 43a 19,24 19,00 >20 >20 2 43b >20 >20 >20 >20 3 43c >20 >20 >20 >20 4 43d >20 >20 >20 >20 5 43e >20 >20 >20 >20 6 43f 16,38 16,90 17,67 9,52 16 7 43g 15,96 19,11 15,34 12,03 8 43h >20 19,20 >20 16,40 9 43i >20 >20 >20 >20 10 6-mercaptopurin 19,10 18,75 19,72 16,04 11 Indirubin >20 >20 >20 >20 12 Indirubin-3ʹ-oxime 14,26 13,11 15,87 14,90 13 Ellipticine 2,19 1,91 1,79 2,40 Kết quả thử nghiệm hoạt tính gây độc và chống tăng sinh tế bào ung thư trên bảng cho thấy hai dẫn xuất 43f và 43g có hoạt tính trên cả bốn dòng tế bào thử nghiệm, giá trị IC50 dao động từ 9,52÷19,11 µM. Hai hợp chất 43a và 43h thể hiện hoạt tính gây độc yếu trên hai dòng tế bào ung thư. Năm dẫn xuất còn lại không thể hiện hoạt tính ở nồng độ nghiên cứu. 4.2.3. Đánh giá hoạt tính chống ung thư các dẫn xuất mới của indirubin 45a-45h Bảng 4.15. Hoạt tính gây độc và chống tăng sinh tế bào in vitro các dẫn xuất mới của indirubin 45a-45h và các chất đối chứng dương TT Hợp chất IC50 (μM) SW480 LU-1 HepG2 HL-60 1 45a >20 >20 >20 >20 2 45b >20 >20 >20 >20 3 45c >20 >20 >20 >20 4 45d >20 >20 >20 >20 5 45e >20 >20 >20 >20 6 45f 1,65 2,21 1,90 1,35 7 45g >20 >20 >20 >20 8 45h 4,19 4,53 4,47 4,28 9 6-mercaptopurin 19,10 18,75 19,72 16,04 10 Indirubin >20 >20 >20 >20 11 Indirubin-3ʹ- oxime 14,26 13,11 15,87 14,90 12 Ellipticine 2,19 1,91 1,79 2,40 17 Kết quả thử nghiệm hoạt tính gây độc và chống tăng sinh tế bào ung thư trên bảng cho thấy hai dẫn xuất 45f và 45h có hoạt tính trên cả bốn dòng tế bào thử nghiệm, giá trị IC50 dao động từ 1,35÷4,53 µM. Sáu dẫn xuất còn lại không thể hiện hoạt tính ở nồng độ nghiên cứu. 4.2.4. Đánh giá hoạt tính chống ung thư các dẫn xuất mới của indirubin 53a-53l Bảng 4.16. Hoạt tính gây độc và chống tăng sinh tế bào in vitro các dẫn xuất mới của indirubin 53a-53l và các chất đối chứng dương TT Hợp chất IC50 (μM) SW480 LU-1 HepG2 HL-60 1 53a >20 >20 >20 >20 2 53b >20 >20 >20 >20 3 53c >20 >20 >20 >20 4 53d >20 >20 >20 >20 5 53e >20 >20 >20 >20 6 53f >20 >20 >20 >20 7 53g >20 >20 >20 >20 8 53h >20 >20 >20 >20 9 53i >20 >20 >20 >20 10 53k >20 >20 >20 >20 11 53l >20 >20 >20 >20 12 Indirubin >20 >20 >20 >20 13 Indirubin-3ʹ- oxime 14,26 13,11 15,87 14,90 14 Ellipticine 2,19 1,91 1,79 2,40 Kết quả thử nghiệm trên bảng cho thấy tất cả các dẫn xuất 53a- 53l đều không thể hiện hoạt tính gây độc và chống tăng sinh trên cả bốn dòng tế bào ung thư ở nồng độ nghiên cứu. 4.2.5. Đánh giá hoạt tính chống ung thư các dẫn xuất mới của indirubin 56a-56p 18 Bảng 4.17. Hoạt tính gây độc và chống tăng sinh tế bào in vitro các dẫn xuất mới của indirubin 54, 55, 56a-56p và các chất đối chứng dương TT Hợp chất IC50 (μM) SW480 LU-1 HepG2 HL-60 HEK-293 1 54 >20 >20 >20 >20 >20 2 55 18,58 19,55 >20 15,27 16,22 3 56a 3,36 2,26 3,56 2,39 3,21 4 56b >20 >20 >20 >20 >20 5 56c 3,80 2,99 3,38 1,43 1,19 6 56d 4,46 2,85 3,76 3,40 2,01 7 56e 4,66 3,28 4,62 3,27 6,98 8 56f 2,54 1,30 2,01 0,98 1,03 9 56g 4,10 3,96 5,68 4,82 1,80 10 56h 14,13 8,74 14,23 6,50 9,74 11 56i 3,43 2,07 2,28 1,28 0,85 12 56k 2,91 2,50 2,95 1,29 1,92 13 56l 3,03 2,07 3,28 1,28 7,12 14 56m 14,36 8,74 15,31 15,96 11,93 15 56n 12,54 10,08 11,70 10,44 9,52 16 56o 11,16 8,80 11,68 9,39 5,89 17 56p 11,71 8,61 10,61 11,25 7,72 18 Indirubin >20 >20 >20 >20 >20 19 Indirubin- 3ʹ-oxime 15,65 16,36 16,00 16,50 14,16 20 Ellipticine 1,76 2,50 1,93 2,19 0,32 Dựa vào kết quả ở Bảng 4.17 nhận thấy hợp chất trung gian 55 thể hiện hoạt tính ở mức yếu với các dòng SW-480, LU-1 và HL-60. Các tổ hợp lai của indirubin với hydroxychalcone qua liên kết methylen 1,2,3-triazole 56a-56l thể hiện hoạt tính mạnh hơn rõ rệt so với các tiền chất, ngoại trừ hợp chất 56b với sự có mặt đồng thời của 3 nhóm methoxy (CH3O-) ở các vị trí R2, R3, R4 không thể hiện hoạt 19 tính trên tất cả các dòng tế bào ung thư ở nồng độ nghiên cứu. Hợp chất 56f thể hiện hoạt tính gây độc và chống tăng sinh mạnh nhất trên các dòng tế bào ung thư SW480, LU-1, HepG2 và HL-60 với giá trị IC50 tương ứng là 2,54; 1,30; 2,01 và 0,98 μM, cao hơn rõ rệt so với indirubin-3'-oxime. Phân tích tương quan giữa cấu trúc của hợp chất 55, indirubin-3'-oxime, dãy dẫn xuất 56a-56p kết hợp với hoạt tính thử nghiệm dẫn tới giả thuyết sự hiện diện của nhóm oxime (=N-OH) trong cấu trúc có thể đóng vai trò quan trọng đối với hoạt tính gây độc và chống tăng sinh tế bào ung thư. Giả thuyết này cũng phù hợp với kết quả thử hoạt tính của dãy 53a-53l (Bảng 4.16), các dẫn xuất indirubin bị mất nhóm oxime (cùng có hợp phần hydoxychalcone tương tự) đều không thể hiện hoạt tính. Đáng lưu ý là ba tổ hợp lai 56e, 56h, 56l của indirubin-3'-oxime với hydroxychalcone qua liên kết methylen 1,2,3-triazole có nhóm thế methoxy (CH3O-), ethoxy (C2H5O-), propoxy (n-C3H7O-) ở vị trí R3 (nhóm thế ở vị trí para trong hợp phần aldehyde của hydroxychalcone) được quan sát là có thể tác động tới khả năng gây độc chọn lọc giữa tế bào ung thư và tế bào thường. Bằng chứng là giá trị IC50 của các chất 56e, 56h, 56l trên dòng tế bào thường thận HEK-293 tương ứng là 6,98; 9,74; 7,12 μM cao hơn so với trên các dòng tế bào ung thư đồng nghĩa với độc tính thấp hơn, có thể sử dụng cho các nghiên cứu sâu hơn về khả năng chống ung thư. Các dẫn xuất 56m-56p đều thể hiện hoạt tính gây độc và chống tăng sinh trên các dòng tế bào ung thư mạnh hơn hợp chất indirubin- 3'-oxime, nhưng nói chung yếu hơn các dẫn xuất 56a-56l. Tuy nhiên những chất này có thể tạo dạng muối tan với các axít và làm tăng sinh khả dụng của các chất này. 4.3. Mối tương quan giữa cấu trúc và hoạt tính chống ung thư của các chất Để giải thích tại sao các chất tổng hợp ở trên, có chất không thể hiện hoạt tính chống ung thư ở nồng độ nghiên cứu, có chất thể hiện 20 hoạt tính
File đính kèm:
 tom_tat_luan_an_tong_hop_va_danh_gia_tac_dung_sinh_hoc_cac_d.pdf
tom_tat_luan_an_tong_hop_va_danh_gia_tac_dung_sinh_hoc_cac_d.pdf Trích yếu luận án.pdf
Trích yếu luận án.pdf TRang thông tin đóng góp mới tiếng việt.pdf
TRang thông tin đóng góp mới tiếng việt.pdf Tóm tắt-TS Tiếng Anh.pdf
Tóm tắt-TS Tiếng Anh.pdf QĐ thành lập HĐ đánh giá luận án tiesn sĩ cấp học viện.pdf
QĐ thành lập HĐ đánh giá luận án tiesn sĩ cấp học viện.pdf Đóng góp mới LA-Tiếng Việt-Dân.doc
Đóng góp mới LA-Tiếng Việt-Dân.doc Đóng góp mới LA tiếng Anh-Dân.pdf
Đóng góp mới LA tiếng Anh-Dân.pdf

